
A study on viruses, immune vaccines, and intelligent design
Seung Won Yang*
Genesis Research Center (30, Changgyeonggung-ro 26-gil, Jongno-gu, Seoul, Republic of Korea),
*Corresponding Author. E-mail: rmuell@hanmail.net; Tel.: 82-2-763-4001
바이러스와 면역 백신, 지적설계에 관한 연구
양승원*
제네시스연구소(창경궁로26길 30/02-763-4001)
*교신저자 E-mail: rmuell@hanmail.net; Tel.:82-2-763-4001
요약
본 연구는 생명과학의 영역 가운데 바이러스와 백신, 정보이론 및 생체모방과학 관련 이론들을 언급하였다. 세포 안에 존재하는 유전자를 구성하는 DNA는 언어체계를 가진 정보로써 작동하여 설계 지성의 활동을 가리킨다. 역으로 유전자의 변이와 유전병, 바이러스에 의한 정보의 변경이 정상적인 몸의 작동을 어렵게 하고 병을 일으키는 것은 유전정보가 몸의 설계도임을 드러내며, 이는 그것이 정교한 규칙과 정보를 가진 것을 의미한다. 특별히 바이러스에 대한 기본 정보와 역할, 기원 등에 관한 내용을 살펴보고 더불어 백신과 면역작용 등의 내용도 살펴보았다.
Abstract: Among the areas of life sciences, this study mentions theories related to viruses and vaccines, information theory and biomimicry. DNA, which constitutes the genes in a cell, operates as information with a language system, pointing to the activity of a designing intelligence. Conversely, the alteration of information by genetic mutations, genetic diseases, and viruses disrupts the normal operation of the body and causes disease, revealing that genetic information is the blueprint of the body, which means that it has sophisticated rules and information. In this article, we will discuss the basic information about viruses, their roles, origins, and more, as well as vaccines and immunity.
Key Words : virus, vaccine, recombinant vaccine, biomimicry, intelligent design 바이러스, 백신, 재조합 백신, 지적설계, 생체모방과학
서론
2019년 중국에서 처음 발병한 신종 코로나바이러스(SARS-CoV-2)로 인한 감염증은 전 세계적인 팬데믹 유행으로 사람들이 목숨을 잃었다. 2023년 7월 현재는 국내를 포함하여 전 세계 대부분 국가에서 백신 접종과 치료제 등을 통하여 안정세를 보이고 있고 실내외 출입제한이 해제되었지만, 아직도 수천 명의 환자가 꾸준히 발생하고 있다. 이번 코로나19 대유행을 통하여 우리는 많은 생명의 위협과 경제적 손실 등 유무형의 고통이 있었다. 그러나 다른 한편으로는 다가올 또 다른 전염병의 유행을 대비하는 백신 개발의 기회가 되기도 하였다고 볼 수 있다. 갈수록 늘어가는 기상이변과 재난, 재해를 볼 때 앞으로 메르스나 코로나보다 더 강한 바이러스나 슈퍼세균들이 등장할 가능성은 그 어느 때보다 크다. 동시에 바이러스에 대한 잘못된 정보의 유행 가능성도 크다.
바이러스는 한 식물이나 동물에서 다른 식물이나 동물로 유전자를 운반하는 기능을 포함하는 종자 및 포자와 유사하다. 기생과 증식을 위해서는 숙주가 필요한데 무조건 숙주에 악영향을 미치는 것은 아니다. 바이러스는 생명에 중요한 다양성을 생산하는 데 도움이 되는 시스템의 일부이며, 중요한 것은 한 유기체에서 다른 유기체로 질병에 대한 저항성을 전달하기도 한다. 대부분의 바이러스는 문제를 일으키지 않고 숙주에 상주하는데, 문제는 돌연변이 또는 유전자의 우연한 이동으로 인간의 질병과 고통을 유발하도록 의도적으로 설계된 시스템의 증거가 아니다.
바이러스는 무엇이고 그것의 역할과 기원은 어떻게 되는가? 백신들이 만들어지고 있는데 백신이란 무엇이고 그것의 원리와 종류에 대하여 나누어 보고자 한다. 이러한 연구를 통하여 바이러스는 우연히 생겨난 진화의 산물이 아니라는 사실을 알 수 있을 것이다.
본론
1. 바이러스의 정의와 기원
1.1. 바이러스의 정의
바이러스(virus)는 독성물질(poison)이란 의미가 있는 라틴어의 virus(비루스)에서 유래하였다. 바이러스는 다른 유기체의 살아 있는 세포 안에서만 기생, 증식하는 전염성 감염원이자 생물과 무생물의 중간적 존재(비세포성 반 생물)로 증식을 위해서는 숙주(host)가 필요하다. 바이러스는 박테리아와 동물을 포함한 동물과 식물에서 미생물에 이르기까지 모든 종류의 생물체를 감염시킬 수 있다. 작은 박테리아를 감염시키는 바이러스도 있는데 이것을 박테리오파지(bacteriophages)라고 불린다. 박테리오파지는 24시간 바다에 있는 대부분의 박테리아를 주기적으로 용해시켜, 바다가 건강해지도록 만드는 데에 기여한다. 바이러스는 RNA나 DNA의 유전물질과 그것을 둘러싸고 있는 단백질 껍질(capsid, 캡시드)로 구성되는 매우 간단한 구조를 가진다. 단백질 껍질(캡시드)은 구슬 모양의 단백질(capsomere, 캡소머)이 모여 이루어진 것이다.
바이러스는 숙주의 종류에 따라서 식물 바이러스, 동물 바이러스 그리고 세균 바이러스(파지)로 나눈다. 그러나 생물 증식의 근원이 핵산(nucleic acid)이라고 불리는 유전체에 있으므로 2종류(DNA, RNA)의 유전체의 종류에 따라 RNA 바이러스와 DNA 바이러스로 구분할 수 있는데 대부분의 DNA 바이러스는 숙주의 세포핵과 결합하여 숙주의 DNA를 대체하고 대부분의 RNA 바이러스는 세포질에서 숙주의 리보솜을 이용하여 복제된다. 즉, 바이러스는 증식에 필요한 효소를 가지고 있지 않으므로, 다른 생물에 기생하면서 숙주가 가진 것을 이용하여 증식한다. 천연두나 수두, 감기를 일으키는 바이러스나 대장균에 기생하는 T 파지는 DNA 바이러스이다. 이와는 달리, 코로나바이러스와 홍역·광견병·소아마비·일본 뇌염 등을 일으키는 바이러스는 RNA 바이러스이다.
바이러스의 복제 경로는 두 가지가 있는데 용균성과 용원성으로 나뉜다. 용균성(lytic)이란 숙주 세포를 감염시킨 후 숙주 세포를 파괴하며 복제된 바이러스가 외부로 방출되는 것을 말한다. 용원성(lysogenic)은 숙주 세포를 감염시킨 후 숙주 세포 염색체의 일부로 끼어 들어가는데 세포 분열 시 바이러스의 유전물질도 같이 복제되며, 암을 유발하기도 한다. 바이러스는 숙주 세포의 에너지와 대사활동을 가로채 자신의 복제에 이용하기 때문에 살아 있는 세포 안에서만 복제될 수 있다. 바이러스 복제는 흡착(adhesion)-침입(invasion)-삽입(release)-형성(assembly)-방출(release)의 과정을 거친다.
1.2. 바이러스의 기원
바이러스의 기원은 과학계에서 아직은 명확하게 정의 내리지는 못하고 있다. 진화론에서는 DNA나 RNA에서, 또는 단백질에서 기원했다고 보고 있으며 미생물보다 먼저 존재했다는 설과 나중에 진화했다는 설 등으로 의견이 분분하다. 또 다른 이론으로 진핵생물의 세포 안에 매우 높은 비율로 존재하는 ‘역위 트랜스포존(retro-transposon)’에서 바이러스가 유래되었다는 가설이 있다. 염색체의 DNA 서열 중에는 한 부분에서 다른 부분으로 옮겨갈 수 있는 움직이는 유전자가 있다. 이것을 트랜스포존(transposon) 또는 점핑 유전자(jumping gene)라고 한다. 이 트랜스포존 중에는 ‘역위 트랜스포존’이라는 것이 있는데 자신의 DNA 유전정보를 복사해서 RNA를 만들고, 이 RNA를 이용해 다시 자기 자신과 같은 DNA 조각을 만든다. 이 복제된 DNA 조각이 염색체의 DNA 서열 중 원래 자기 자리에서 벗어나 다른 자리에 삽입된다. 이런 방식으로 역위 트랜스포존은 자기 DNA의 복제품을 게놈 안에 증식해 갈 수 있다. 이러한 역위 트랜스포존이나 여기서 나온 RNA가 우연히 막에 싸여 세포 밖으로 나가게 되면서 바이러스가 만들어졌다는 설이다. 또한, 동물이나 식물, 미생물 등의 유전자 재조합이 바이러스의 생성 원인이라고 주장하고 있다.
반진화론 입장에서는 미생물을 분해하는 역할이나 유전정보를 변화시키는 다양한 기능들을 볼 때 바이러스 자체가 설계되어 만들어졌다고 보고 있다. 일부 연구에서 보듯이 연구자들은 '프로바이러스(proviruses)'라 불리는 두 DNA 염기서열이 재조합(recombination)을 통하여 함께 모아졌을 때, XMRV(xenotropic murine leukemia virus–related virus)라 불리는 레트로바이러스(retrovirus)가 형성되었다는 것을 발견했다. 이는 바이러스가 진화에 의해서 우연히 생겨난 것이 아니라, 유전적 기능을 위해 만들어져 시작되었다는 해석을 하고 있다. 어떤 유전정보를 한 세포에서 다른 세포로 전달하기 위해서, 작은 로봇으로 바이러스가 만들어졌을 가능성이 있다. 왜냐하면, 인간도 바이러스를 암을 파괴하는 도구로 사용하는 유전자 치료 및 백신 유전정보 전달자(아스트라제네카 백신)로 사용하고 있다는 것을 근거로 들고 있다.
1.3. 바이러스의 구조와 언어의 원리
또한, 바이러스는 간단한 단백질 구조의 유전체와 외피로 이루어져 있는데 바이러스의 유전체가 간단한 구조를 가진다고 할지라도 복제가 이루어지려면 명령어가 질서 있게 체계적으로 전달되어야 한다. DNA는 여러 면에서 하나의 언어를 닮았다. 암호(code)를 작성하려면 먼저 마음(mind) 또는 지성(intelligence)으로부터 시작해야 한다. 그런 다음 암호를 알고 있는 발신자와 수신자를 설계해야 한다. 지성이 없는 기호는 무의미하다. 유전자에서 DNA는 정보를 3차원적 구조로 저장한다. DNA는 이 우주 내에서 알려진 것 중에서 가장 극도로 고집적 되어있는 정보저장 메커니즘이다. 이러한 믿을 수 없는 고집적 정보저장 시스템의 설계는 우연히 만들어졌다는 설을 부정한다.
2. 바이러스 백신과 지적설계의 증거
바이러스(virus)는 특정 단백질을 찾아 달라붙어 세포 내로 유전자를 주입, 숙주 정보를 변경, 자신을 확장하여 숙주를 파괴하거나 숙주를 자신의 공장으로 만들어 바이러스 자신의 정보를 계속해서 만들게 하는 특징을 가지고 있다. 이후 세포 밖으로 나와 또 다른 숙주를 감염시킨다. 인간은 물론 대부분 동물에는 체외로부터 체내로 들어온 세균 등의 침입자에 대해서 항체라는 물질을 만들고 혈액 속에 분비하여 자기를 비자기(非自己)로부터 방어하는 기능을 갖추고 있다. 따라서 외부 침입자를 식별할 수 있는 항체를 먼저 갖추고 있다. 외부 침입자를 식별할 수 있는 항체를 먼저 갖추고 있다면 이 침입자를 배제할 수 있게 되어 병을 사전에 예방할 수 있게 되는 것이다.
2.1. 백신과 지적설계
1796년 이드워드 제너(E. Jenner)가 한 목동에게 우두(cowpox) 바이러스를 접종하여 천연두(smallpox)에 대한 면역성을 얻게 하는 데 성공(종두법)한 이후로 다양한 병원성 균(항원)에 대한 백신이 개발되어 질병으로부터 인간을 보호하는 데 공헌해왔다. 제너는 소의 젖을 짜는 여성이 천연두에 걸리지 않는다는 것을 알게 되어 천연두와 비슷한 질환인 우두를 경험한 사람으로부터 채취한 고름이 천연두를 막을 수 있다는 가정을 세웠다. 젖소의 유방에 궤양이 생기는 질환인 우두에 걸렸던 사람은 천연두에 걸리지 않은 것에 착안하여 천연두의 백신(생백신 원리)을 만들어 냈다. 8세 소년에게 우두를 앓는 사람의 고름을 주입하는 방법을 시험했는데 접종 이후 미열이 발생했지만, 본격적인 감염이 일어나지 않고 수일 뒤에 건강을 되찾았다. 6주 후에 제너는 이 소년에게 진짜 천연두 고름을 접종했고, 제너의 예상대로 이 소년은 천연두에 걸리지 않았다. 제너는 우두(cowpox)를 라틴어로 소의 천연두(Variolae vaccinae)라고 표현했는데, 라틴어의 vacca(바카)는 암소를 의미하고 variolae(바리올래)는 천연두를 의미한다. 예방접종(vaccination)과 백신(vaccine)이라는 단어가 여기에서 시작되었다.
최초의 불활성화 백신(사백신)은 루이 파스퇴르가 개발한 ‘광견병 주사’로 당시엔 전자현미경이 개발돼 있지 않아 광견병의 원인인 바이러스를 발견할 수 없었는데, 파스퇴르는 광견병에 걸린 토끼의 뇌를 석탄산(carbolic acid)으로 처리한 다음 백신으로 사용했다. 지금까지 사용되고 있는 불활성화 백신으로는 소아마비, 독감(인플루엔자) 백신도 불활성화 백신의 일종이며, 인플루엔자, 일본 뇌염, 광견병, A형간염, B형간염, 유행성출혈열 등 많은 바이러스 질환 백신을 이 방법으로 만든다. 세균 질환의 경우 백일해, 장티푸스, 콜레라, 폐렴 등이다. 신종 코로나바이러스 감염증(코로나19) 백신을 불활성화 백신으로 만드는 일도 있었는데, 중국이 개발한 시노팜, 시노백 등의 백신은 이런 불활성화 백신 형태로 만든 경우이다. 세계보건기구(WHO)는 지난 2021년 시노팜의 코로나19 백신 사용을 긴급 승인했다. 이 외에도 바이러스 항원 유전자를 다른 바이러스에 넣어 투여하는 바이러스 백신, 바이러스 항원 유전자를 mRNA 형태로 투여하는 mRNA 백신, 항원 단백질을 바이러스와 유사한 입자 모양으로 만들어 투여하는 VLP 백신 등이 있다.
백신이라는 것은 바이러스나 세균 또는 그 독소들이 몸속에서 증식하여 병을 유발하지 못하도록 포르말린 등으로 처리하여 미리 죽이거나(사백신) 독성을 약화시킨 물질(약독화 생백신)을 말하는데, 이것을 몸에 접종(예방주사)함으로써 중화항체의 생산(B세포 담당)을 활성화시켜 그 병원성 균에 대한 면역을 후천적으로 획득하도록 돕는 것이다(후천성 면역작용). 선천성 면역작용으로는 인터페론(당단백질)의 분비 등으로 바이러스 등 병원체에 대한 면역 반응을 활성화하는 경우로 신종 코로나(SARS-CoV-2) 같은 바이러스가 침투하면 인체의 관련 면역세포는 인터페론 알파(interferon-alpha)를 생성해 바이러스의 RNA와 단백질 합성을 방해하여 바이러스의 복제를 막는다.
이처럼 병원성 균을 직접 죽이거나 독성을 약화시키는 약독화(弱毒化) 작업을 시켜 접종하는 기존의 백신을 제1세대 백신이라 한다. 이러한 기존의 백신은 대체적으로 안전하지만, 가끔 부작용(면역원성 단백질 중화항체 외에도 다른 항체들이 많이 생성)이 나타나기도 하고 대량생산을 하는 데 있어서 제한을 받고 있어, 최근에는, 병원성 세균이나 바이러스가 가진 표면단백질(항원, H/N)을 유전자 재조합 기술로 생산하여 얻는 제2세대 백신 개발(재조합 백신 또는 단백질 백신)에 많은 연구와 투자를 하고 있다. 재조합 백신은 바이러스의 유전자 없이 표면 항원 단백질만을 생명체에 접종해서는 병을 유발시키지 못하므로 1세대와 비교해서 안전하다. 따라서 유전자 재조합에 의해 표면항원단백질을 단백질 발현을 도와주는 샤페론(또는 샤페르나)의 도움을 받아 대장균이나 효모(Yeast) 등에서 생산하게 되면 백신의 대량으로의 생산이 가능하다. 그리고 바이러스 유사 입자(VLP-virus like particle) 등의 자가 조립(self-assemble) 유도를 통하여 안전하고 효율이 좋은 백신 생산이 가능하게 되었다.
제3세대 백신은 코로나19 백신으로 개발된 모더나, 화이자의 mRNA 백신으로 코로나19 바이러스의 표면을 둘러싸고 있는 쇠뿔 모양 돌기인 단백질 스파이크를 흉내 낸 가짜 스파이크 단백질의 유전정보인 mRNA를 지질 나노입자 안에 집어넣어 세포 내로 삽입하는 방식이다. 세포 내로 삽입된 mRNA는 세포 내 소기관들을 이용하여 체내에 스파이크 단백질(백신 역할)을 미리 만들어 놓아 이에 대한 면역력을 생성하는 원리로 작동한다. 2020년 11월 독일의 바이오엔테크와 미국의 화이자가 공동개발한 BNT162b2가, 12월 미국의 모더나와 국립알레르기·전염병연구소 (NIAID)가 공동 개발한 mRNA-1273이 각각 FDA 승인을 받았다.
바이러스의 증식 방법이 다른 숙주의 유전자를 자신의 유전자로 바꿔치기하여 숙주를 생산하는 것이 아닌 바이러스를 생산하도록 정보가 변경되어 숙주가 죽게 되는 것이다. 이러한 정보의 변경은 설계도의 변경을 의미하며 설계도 정보의 변경은 생명체의 죽음을 또한 의미한다. 유전자 재조합 단백질 백신이라는 것도 바이러스의 표면 항원 단백질 정보를 복사하여 바이러스를 잡는 것이기에 설계의 개념이 강력하게 드러나고 있다.
2.2. 정교하게 설계된 바이러스
T4 박테리오파지의 외형은 마치 아폴로 11호 달착륙 우주선의 외형을 닮았다. 외형만이 아니라 착륙과정까지도 서로 닮아있다. T4 박테리오파지의 대장균 내 감염은 박테리오파지의 흡착기관인 꼬리의 기저판과 대장균 세포벽 표면에 있는 수용체 간의 연결에 의하여 일어난다. 대장균은 한 종류만 있는 것이 아니라 많은 종류가 있고 파아지도 그에게 맞게 찾아내어 감염을 시킨다. 꼬리에 있는 기저판과 꼬리 섬유가 있는데 이를 통하여 숙주를 확인하는 것이다. 크기 또한 자신보다 약 20배가량 큰 숙주를 정확히 찾아 감염시키는 것은 우주선이 달을 찾아 착륙하는 것보다 훨씬 어려운 일로 우연이라고 하기에는 정교한 기술이 필요한 작업이다.
또한, 252개의 캡소머가 모여 정이십면체의 구조를 만드는 바이러스인 아데노바이러스는 그 구조 자체만으로 정교한 기술을 요한다. 20면체의 각 꼭짓점 12개의 펜톤 캡소머에는 펜톤 섬유가 마치 인공위성의 모습처럼 달려있다. 인간이 만들기 위해서도 20면체 전개도(설계도)가 필요하듯이 아데노바이러스의 구조 자체는 우연히 조합될 수 없다.
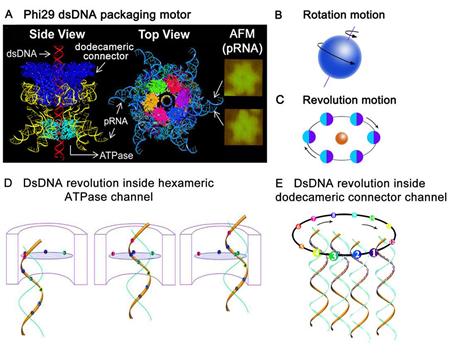
박테리오파지(bacteriophages)의 DNA는 그것을 붙잡고 있는 작은 용기인 단백질 껍질(capsid)의 직경에 비해 1,000배나 더 길다. 분자 모터(molecular motor)에 의해서 내부로 감기는 것이 밝혀졌다. 박테리오파지의 모터는 기어(gears)들을 가지고 있는데 이 기어들은 DNA가 포장되기 전에 풀려질 필요가 있을 때 편리하도록 해준다. 바이러스는 5분 안에 자신의 DNA를 포장할 수 있는 단백질 포장 모터가 있는데 기어의 역할을 하는 단백질과 너트와 볼트(nuts and bolts)역할을 하는 단백질도 있다. 그것은 DNA 가닥 둘레를 감싸고 있는 하나의 고리 안에 5개의 단백질로 이루어져 있다. 기어들은 DNA를 포장하기 위해 시계 반대 방향으로 움직이어 캡시드 안으로 한 번에 두 개의 DNA 염기들을 밀어 넣는 것을 볼 수 있다. 이는 정교한 기계의 모습을 볼 수 있으며 우연이라고 볼 수 없는 설계된 증거이다.
2.3. 정보 자체의 존재와 전달, 변질을 통한 생존
바이러스는 정보만으로 생명력을 유지한다. 단 숙주가 필요하다는 전제 조건이 있다. 인간의 법이나 도덕 자체도 숙주(?)인 인간을 살리는 역할을 하듯 숙주를 망가뜨리는 바이러스의 정보만으로도 자신을 복제하여 바이러스의 양을 증가시키는 목적을 달성시킨다. 바이러스가 숙주에서 살아가는 주된 방법은 정보의 변질이다. 컴퓨터의 프로그램들과 운영체계의 명령어들을 혼란시켜 변형이 일어나게 하여 파괴해 버리는 컴퓨터 바이러스와 같이 생명체를 감염시키어 숙주의 DNA를 자신의 유전자와 단백질을 만들게 하는 정보의 변질이 주된 생명력 유지 방법이다. 법이나 도덕도 변질이 되거나 지켜지지 못하게 되면 인간 사회를 망가뜨리고 결국 멸망으로 인도하는 것과 마찬가지의 원리이다. 어느 정도 숙주를 감염시킨 바이러스는 시간이 지나면서 자신의 정보를 변질(돌연변이)시켜 다시금 숙주 내 감염을 연장시키는 것을 볼 수가 있다. 법이나 질서를 왜곡하여 해석하면 또 다른 왜곡을 낳게 되고 더 많은 사람에게 계속해서 혼란을 주어 죄가 퍼져나가는 것과 유사하다.
항원을 이용한 백신은 몸에서 항체를 만들어 내어 바이러스를 무력화(중화)시킨다. 이것은 학교에서 배우는 범죄 예방 교육과 준법의식, 도덕교육이 인간 사회를 지키기 위한 백신 접종에 해당한다. 항체를 만들어 내는 B세포와 바이러스를 무력화시키는 T세포, 항원 제시 세포들은 도덕과 법을 제대로 이해시켜주는 부모와 선생님의 역할을 하는 것으로 볼 수 있다. 백신은 곧 올바른 정보를 분별하고 얻기 위한 작업으로 볼 수 있다. 백신 접종의 부작용으로는 보통 바이러스에 의한 질병과 유사한 경미한 고통 등을 미리 경험하게 되는데 이것은 항체를 만드는 과정 중의 하나이다. 특별히 코로나바이러스 RNA 백신은 포장전달물질인 지질 나노입자에 의한 부작용(alum과 같은 백신 보조첨가제도 동일한 부작용 발생)이 발생할 수 있는 것처럼 인간 사회를 위한 법이나 도덕이 아닌 다른 것들이 전달될 때에 부작용이 나타날 수 있다는 것을 기억해야 할 것이다.
2.4. 유전자 치료와 지적설계증거
유전병이란 유전자의 본체인 DNA 염기서열에 이상이 발생하여 일어나는 질환의 총칭으로 좁은 의미로는 특정 유전자가 양친에게서 물려받아 '유전되는 병'(hereditary disease)을 의미한다. 그리고 유전자 치료란 염기서열의 순서가 바뀌거나 빠져있는 결함이 있는 유전자를 정상인 유전자로 원위치시켜 유전적인 문제를 해결하거나 새로운 기능을 추가하는 치료법을 말한다. 유전자를 치료하는 치료법은 환자의 유전자를 포함한 유전체 전체 구성에 변화를 초래하여 몸을 치료하는 모든 의료절차를 유전자 치료로 간주하기도 한다. 기본적으로 생각해보면 유전자 치료의 주요한 목적은 유전자의 오류로 인해 생기는 유전병을 앓고 있는 사람의 유전자의 결함을 교정하여 치료하는 데 있다. 유전자 치료법에는 두 종류의 치료법이 있는데, 체세포 유전자 치료법과 생식 세포 유전자 치료법이 그것이다.
유전자 치료법의 간단한 원리는, 바이러스 안에 존재하는 원형 플라스미드 DNA를 운반체로 사용하여 환자에게 필요한 유전자 염기 배열을 운반체에 삽입하여 환자의 세포 안에 있는 유전체에 넣어주는 것이다. 일반적으로 정맥에 교정된 유전자를 포함하는 바이러스 운반체를 주사하여 몸 안에 있는 각 세포 내로 유도하는 방법을 이용한다. 인간의 몸에 최소한의 피해를 주는 바이러스를 사용하여 유전자를 교정하여 세포 내에 삽입하였음에도 불구하고, 유전자 변형식물이나 동물과 마찬가지로 유전자 변형에 의한 피해가 인간에게 적용된 유전자 치료의 문제점으로 볼 수 있다. 유전자 치료법이 만들어진 초기에는 발현시키기 원하는 단백질의 유전자를 직접 세포 내에 투여하는 데에 중점을 두었다면, 기술이 점점 발전함에 따라 크리스퍼(CRISPR, Clustered Regularly Interspaced Short Palindromic Repeats)와 같은 3세대 유전자 가위 등을 사용하여 직접 원하는 교정된 유전정보를 인간 유전체에 직접 편집을 시도하는 쪽으로 연구가 진행되고 있다.
이러한 유전자 치료를 통하여 알 수 있는 것은 오류를 가진 설계도를 수정하면 정상적으로 몸이 회복된다는 것으로 ‘유전자는 설계도’라는 개념을 지지하고 있는 것이다.
결론
바이러스에 대한 기본 정보와 역할, 기원 등에 관한 내용을 통해 바이러스가 진화의 산물이 아닌 유전정보의 전달과 생태계의 순환이라는 특별한 기능이 있음을 살펴보았다. 더불어 백신과 유전자 치료, 정교한 역할을 하는 바이러스에 대하여도 살펴보았다. 이를 통하여 바이러스는 진화의 산물이 아닌 설계도의 변경에 의한 고장이라는 개념을 지지하며 지적설계의 증거라는 결론을 내릴 수 있다.
참고문헌
조정일 외 2인, 1994, 신비한 생물 창조의 섭리. 국민일보, 서울, 239-244.
Fuller, D. N. et al., 2007, Single phage T4 DNA packaging motors exhibit large force generation, high velocity, and dynamic variability. Proceedings of the National Academy of Sciences, 104(43), 16868-16873.
Guo, P., 2014, Biophysical studies reveal new evidence for one-way revolution mechanism of bacteriophage ϕ29 DNA packaging motor. Biophysical Journal, 106(9), 1837-1838.
Jenner, E., 1800, An inquiry into the causes and effects of the variolae vaccinae: a disease discovered in some of the western counties of England, particularly Gloucestershire, and known by the name of the cow pox. printed, for the author, by Sampson Low...; and sold by Law... and Murray and Hihghley.
Mao, H. et al., 2016, Structural and molecular basis for coordination in a viral DNA packaging motor. Cell reports, 14(8), 2017-2029.
Meyer, S. C., 2009, Signature in the Cell: DNA and the Evidence for Intelligent Design. HarperOne, New York, 611 p.
Paprotka, T. et al., 2011, Recombinant origin of the retrovirus XMRV. Science, 333(6038), 97-101.
Roberts, R. J., 2012, Fish pathology. John Wiley & Sons, West Sussex, 581 p.
Seethaler, S., 2007, Powerful Molecular Motor Permits Speedy Assembly of Viruses. University of California.
Sun, S. et al., 2008, The structure of the phage T4 DNA packaging motor suggests a mechanism dependent on electrostatic forces. Cell, 135(7), 1251-1262.
Suttle, C. A., 2005, Viruses in the sea. Nature, 437(7057), 356-361.
Yang, S. W. et al., 2018, Harnessing an RNA-mediated chaperone for the assembly of influenza hemagglutinin in an immunologically relevant conformation. The FASEB Journal, 32(5), 2658.
그림들(Figures)
그림 1. mRNA 백신의 원리. 바이러스 단백질을 암호화하는 mRNA를 지질나노입자(LNP)에 포장하여 인간 세포 내로 수송하여 면역 반응을 자극하는 바이러스 단백질을 생산하도록 한다. 출처. Trinset/iStock via Getty Images Plus
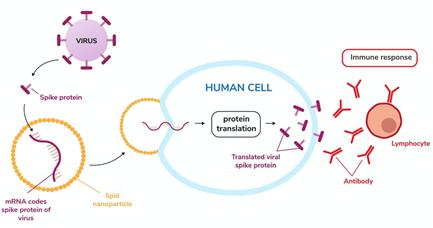
그림 2. 정교하게 설계된 바이러스. 대장균에 달라붙어 있는 T4 박테리오파지의 가상도 (a)와 달 착륙에 성공한 아폴로 11호의 사진 (b)의 비교. 정이십면체 설계도(c)와 아데노바이러스의 모형도(d) 비교.
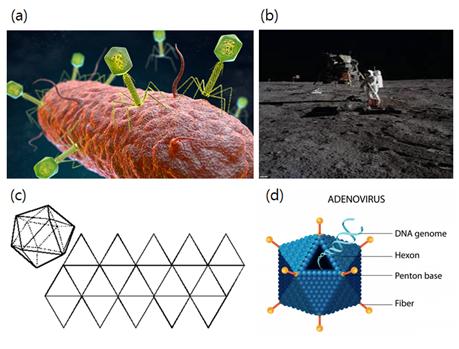
그림 3. 박테리오파지 φ29의 DNA 패키징 분자 모터의 원리. A. 분자 모터 가상도, 자전운동은 자체 축을 중심으로 회전하는 지구와 같고(B) 공전 운동은 지구가 태양 주위를 도는 것과 유사함을 보여주는 그림(C), D. DsDNA가 여섯 개의 ATPase 채널을 통해 안으로 감기는 모습, E. DsDNA가 열두 개의 연결 채널을 통해 안으로 감기는 모습. Guo, P. (2014).
표들(Tables)
표 1. 세대별 백신의 종류
|
|
백신 종류 |
|
제1세대 백신 |
생백신, 사백신 |
|
제2세대 백신 |
단백질 백신, VLP 백신 |
|
제3세대 백신 |
DNA 및 mRNA 백신 |